Penjelasan Tentang Enzim - Enzim adalah protein yang dapat mempercepat reaksi metabolisme. Kerja enzim
ini mirip dengan katalis, zat kimia yang mempercepat reaksi yang pada akhir
reaksi akan diperoleh kembali dalam bentuk semula. Oleh karena itu, enzim
disebut juga biokatalisator.
Enzim mempercepat reaksi dengan cara menurunkan energi (energi aktivasi) yang
diperlukan untuk berlangsungnya reaksi tersebut. Tanpa adanya enzim, reaksi
metabolisme yang terjadi dalam tubuh akan berlangsung sangat lama. Perhatikan
gambar berikut.
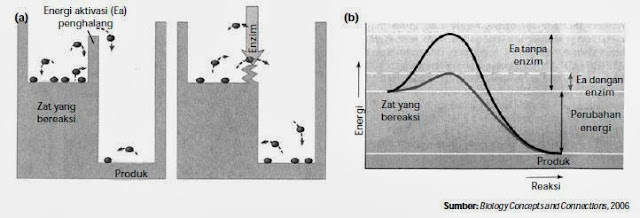 |
| (a) Analogi energi aktivasi dan peran enzim terhadap energi aktivasi (b)
Pengaruh enzim terhadap energi aktivasi. |
Oleh karena enzim terbuat dari protein, setiap enzim memiliki bentuk tiga
dimensi yang unik. Zat yang akan dikatalis oleh enzim disebut substrat. Substrat
akan berikatan dengan enzim pada daerah yang disebut sisi aktif. Zat baru yang
terbentuk dari hasil katalisasi enzim disebut. Sisi aktif pada enzim hanya dapat
berikatan dengan substrat tertentu. Oleh karena itu, enzim bekerja secara
spesifik dan satu jenis enzim hanya akan terlibat dalam satu jenis reaksi saja.
Berikut ini contoh reaksi yang dibantu enzim.
Penamaan enzim pada umumnya sesuai dengan nama substratnya dan diberi akhiran
ase. Contohnya, enzim sukrase yang mengubah sukrosa menjadi glukosa dan fruktosa
seperti contoh di atas.
Sifat Enzim
Enzim memiliki beberapa sifat khas, di antaranya selektif, spesifik, efisien,
sebagai biokatalisator, dan merupakan protein.
- Selektif, Enzim bersifat selektif karena hanya dapat
bekerja pada substrat tertentu. Namun, selain substratnya, enzim dapat juga
berikatan dengan zat penghambat (inhibitor). Hal ini akan dijelaskan lebih
lanjut pada pembahasan berikutnya.
- Spesifik, Enzim bersifat spesifik karena enzim hanya dapat
mengkatalisis reaksi tertentu. Satu jenis enzim hanya bekerja untuk satu jenis
reaksi.
- Efesien, Dengan adanya enzim yang bersifat sebagai katalis,
energi aktivasi suatu reaksi dapat diturunkan. Hal tersebut memudahkan reaksi
dan menghemat energi yang dibutuhkan untuk memulai reaksi.
- Katalisator, Oleh karena enzim bersifat sebagai katalis,
enzim tidak akan mengalami perubahan bentuk. Oleh karena itu, enzim dapat
digunakanberkali-kali tanpa mengalami kerusakan.
- Seperti Protein, Oleh karena enzim terbuat dari protein,
enzim dipengaruhi oleh hal-hal yang berpengaruh terhadap protein. Enzim dapat
dipengaruhi oleh suhu, pH, dan adanya logam berat, sehingga enzim dapat
mengalami denaturasi (perubahan bentuk, struktur, dan sifat).
Cara kerja Enzim
Terdapat dua teori yang menjelaskan cara kerja enzim. Teori lock and key
(kunci dan anak kunci) yang dikemukakan oleh Emil Fischer, serta Teori induced
fit (induksi pas) yang dikemukakan oleh Daniel Kashland.
Teori Lock and Key
Menurut teori ini, cara kerja enzim mirip dengan mekanisme kunci dan anak
kunci. Enzim diibaratkan sebagai kunci gembok yang memiliki sisi aktif. Substrat
diibaratkan sebagai anak kuncinya.
Substrat memasuki sisi aktif enzim seperti anak kunci memasuki kunci gembok.
Substrat tersebut, kemudian diubah menjadi produk. Produk ini kemudian
dilepaskan dari sisi aktif dan enzim siap menerima substrat baru.
 |
| Ilustrasi kerja enzim menurut teori Lock and Key |
Teori Indiced Fit
Berdasarkan Teori Induced Fit, enzim melakukan penyesuaian bentuk untuk
berikatan dengan substrat. Hal ini bertujuan meningkatkan kecocokan dengan
substrat dan membuat ikatan enzim substrat lebih reaktif.
Molekul enzim memiliki sisi aktif tempat melekatnya substrat dan terbentuklah
molekul kompleks enzim-substrat. Pengikatan substrat menginduksi penyesuaian
pada enzim yang meningkatkan kecocokan dan mendorong molekul kompleks
enzim-substrat berada dalam keadaan yang lebih reaktif. Molekul enzim kembali ke
bentuk semula setelah produk dihasilkan.
 |
| Ilustrasi kerja enzim menurut teori indiced fit |
Faktor yang Memengaruhi Kerja Enzim
Terdapat beberapa faktor yang memengaruhi kerja enzim. Faktorfaktor tersebut
erat kaitannya dengan sifat enzim sebagai protein. Faktorfaktor tersebut di
antaranya suhu, derajat keasaman (pH), hasil akhir produk, konsentrasi enzim dan
substrat, serta zat penghambat.
1. Suhu
Enzim terbuat dari protein sehingga enzim dipengaruhi oleh suhu. Suhu
memengaruhi gerak molekul. Pada suhu optimal, tumbukan antara enzim dan substrat
terjadi pada kecepatan yang paling tinggi. Pada suhu jauh di atas suhu optimal
menyebabkan enzim terdenaturasi, mengubah bentuk, struktur, dan fungsinya. Pada
suhu jauh di bawah suhu optimal, misalnya pada 0°C, enzim tidak aktif.
Enzim pada manusia bekerja optimal pada 35–40°C. Mendekati suhu normal tubuh.
Adapun bakteri yang hidup di air panas memiliki enzim yang bekerja optimal pada
70°C.
2. Derajat keasaman (pH)
Seperti protein, enzim juga bekerja dipengaruhi oleh derajat keasaman
lingkungan. Derajat keasaman optimal bagi kerja enzim umumnya mendekati pH
netral, sekitar 6–8. Di luar rentang tersebut, kerja enzim dapat terganggu
bahkan dapat terdenaturasi.
3. Hasil akhir (produk)
Jika sel menghasilkan produk lebih banyak daripada yang dibutuhkan, produk
yang berlebih tersebut dapat menghambat kerja enzim. Hal ini dikenal dengan
feedback inhibitor. Jika produk yang berlebih habis digunakan, kerja enzim akan
kembali normal. Mekanisme ini sangat penting dalam proses metabolisme, yaitu
mencegah sel menghabiskan sumber molekul yang berguna menjadi produk yang tidak
dibutuhkan.
 |
| Peristiwa feedback inhibitor pada pembentukan isoleusin dari treonin |
4. Konsentrasi enzim
Pada rekasi dengan konsentrasi enzim yang jauh lebih sedikit daripada
substrat, penambahan enzim akan meningkatkan laju reaksi. Peningkatan laju
reaksi ini terjadi secara linier. Akan tetapi, jika konsentrasi enzim dan
substrat sudah seimbang, laju reaksi akan relatif konstan.
5. Konsenstrasi substrat
Penambahan konsentrsi substrat pada reaksi yang dikatalisis oleh enzim
awalnya akan meningkatkan laju reaksi. Akan tetapi, setelah konsentrasi substrat
dinaikkan lebih lanjut, laju reaksi akan mencapai titik jenuh dan tidak
bertambah lagi. Setelah mencapai titik jenuh, penambahan kembali
konsentrasi substrat tidak berpengaruh terhadap laju reaksi.
 |
| Grafik pengaruh konsentrasi substrat terhadap laju reaksi |
Pada keadaan laju reaksi jenuh oleh konsentrasi substrat, penambahan
konsentrasi enzim dapat meningkatkan laju reaksi. Peningkatan laju reaksi oleh
peningkatan konsentrasi enzim akan meningkatkan laju reaksi hingga terbentuk
titik jenuh baru.
6. Zat Penghambat
Kerja enzim dapat dihambat oleh zat penghambat atau inhibitor. Terdapat dua
jenis inhibitor, yaitu inhibitor kompetitif dan inhibitor nonkompetitif.
7. Inhibitor kompetitif
Inhibitor kompetitif menghambat kerja enzim dengan cara berikatan dengan
enzim pada sisi aktifnya. Oleh karena itu, inhibitor ini bersaing dengan
substrat menempati sisi aktif enzim. Hal ini terjadi karena inhibitor memiliki
struktur yang mirip dengan substrat. Enzim yang telah berikatan dengan inhibitor
tidak dapat menjalankan fungsinya sebagai biokatalisator
 |
| Cara inhibitor mengganggu pengikatan substrat enzim. (a) Kerja enzim normal,
(b) inhibitor kompetitif, dan (c) inhibitor nonkompetitif |
8. Inhibitor nonkompetitif
Berbeda dengan inhibitor kompetitif, inhibitor nonkompetitif tidak bersaing
dengan substrat untuk berikatan dengan enzim. Inhibitor jenis ini akan berikatan
dengan enzim pada sisi yang berbeda (bukan sisi aktif). Jika telah terjadi
ikatan enzim-inhibitor, sisi aktif enzim akan berubah sehingga substrat tidak
dapat berikatan dengan enzim. Banyak ion logam berat bekerja sebagai inhibitor
nonkompetitif, misalnya Ag
+, Hg
2+, dan
Pb
2+.